Klinikere, som kiropraktorer, fysioterapeuter, naprapater og osteopater, er ofte første kontaktpunkt for pasienter med muskelskjelettplager. Av disse vil veldig mange ha ryggsmerter, og av disse vil igjen en liten andel ha inflammatorisk betingede korsryggsplager som man kaller spondyloartitt. Denne artikkelen vil fokusere på hva vi må kunne i møtet med denne pasientgruppen.
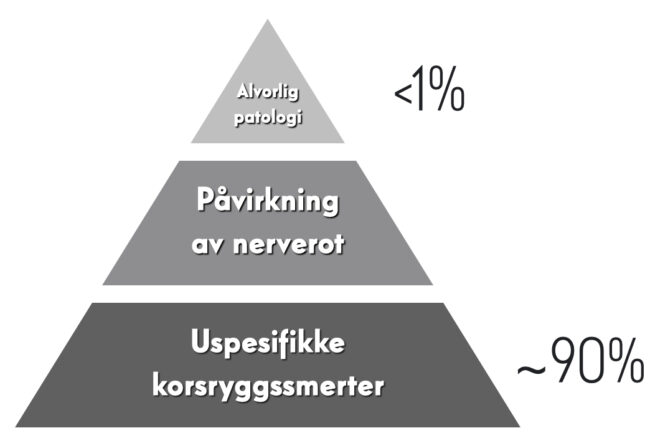
Diagnostisk triage ble utviklet som et rammeverk for å forstå ryggpasienten. Den baserer seg på at man utelukker alvorlige (spesifikke) årsaker til ryggsmerter, slik at disse kan henvises til videre utredning og annen håndtering. Man kan tenke seg en trekant, hvor fundamentet – altså majoriteten av pasientene – betraktes som ikke-spesifikke [1]. I bilde 1 ser man hvordan dette kan illustreres. Klatrer man oppover i pyramiden vil man finne kategorien man kan kalle «nevrologisk betingede symptomer», som på ryggområdet vil være skiveprolapser og andre nevropatier, spinal eller foraminal stenose og nevrologisk affeksjon som følge av spondylolisteser [2]. Av alvorlige årsaker til ryggsmerter finner man malignitet (forskjellige krefttyper), cauda equina syndrom, aorta aneurisme, infeksjoner, epidural abscess, kompresjonsfraktur og inflammatorisk ryggsmerte [2]. Man estimerer at det er <1% av pasienter med korsryggssmerter som vil ha spesifikk årsak til plagene og et sted mellom 5-10% vil være under kategorien nerverotspåvirkning [3]. Denne kunnskapen er utvilsomt hjørnesteinsviten hos de fleste av oss, men samtidig kan denne kunnskapen gi oss en falsk trygghet eller profesjonell apati rundt triagering og den diagnostiske jobben. Antagelsen om at pasienten lider av en uspesifikk tilstand kan, og vil, medføre diagnoseforsinkelse hos en gruppe som bør håndteres i spesialisthelsetjenesten.
Ansvarsfordeling i helsevesenet
Tradisjonelt har fysioterapi vært en naturlig byggestein i det norske helsevesenet. Dette har samtidig sementert fysioterapeutens rolle i hierarkiet ofte som et supplement eller forlengelse av legens diagnostiske rolle. Legen, og i nyere tid fastlegen, har vært den diagnostisk ansvarlige og den med medisinsk kompetanse, mens fysioterapeuten i så måte har vært den som har utøvet legens ønske basert på vedkommendes vurdering. I praksis har naturligvis fysioterapeuter, uavhengig av det politiske spillet og endringer på systemnivå i helsetjenesten, allerede i mange år fungert som primærkontakter i praksis på muskelskjelettområdet. Kiropraktorer og manuellterapeuter har hatt offisiell rolle som primærkontakt med henvisningsrett siden 2006, mens for få år siden bortfalt også henvisningskravet til fysioterapi fra fastlegen. Med andre ord har rollen til fysioterapeuter som førstelinjekontakt blitt enda tydeligere og mer omfattende. Men storpolitikk og svingninger i faget medfører ikke nødvendigvis automatisk kompetanseøkning, og det er åpenbart at som førstelinjeterapeut for pasienter med ryggsmerter, så bør dybdekunnskap om inflammatoriske ryggsmerter være et tydelig prioriteringsområde. Den største grunnen til dette er kanskje den notoriske underkommuniseringen av spondyloartrittens betydning på populasjons- og pasientnivå. Skulle man som fysioterapeut akseptere at kompetanse rundt spondyloartritt ikke var en nødvendig prioritering, så måtte det hvile på følgende to premisser 1) diagnosestillelse ville ikke ha vesentlig betydning for pasientens livskvalitet (smerter, funksjon og arbeidsevne) 2) den naturlige historien til sykdommen var favorabel og tidlig diagnose ikke ville forandre forløpet.
Som vi vil se i denne dybdeartikkelen, så er begge disse premissene grovt feilaktige.
Nomenklatur, klassifisering og epidemiologi
I litteraturen snakker man om aksial spondyloartritt (axial spondyloarthritis) som ’kronisk inflammatorisk sykdom som hovedsakelig rammer det aksiale skjelettet’. Aksial spondyloartritt er igjen en del av spondylatropatiene, som utover de aksiale også er psoriasisartritt, reaktiv artritt og artritt forbundet med inflammatorisk tarmsykdom (Mb Crohn og ulcerøs kolitt) [4]. For å holde denne artikkelen så klinisk relevant og lettfattelig som mulig, vil man fokusere på de aksiale artrittene som rammer det aksiale skjelettet primært.
De aksiale spondyloartrittene (axSpA) deles inn i to hovedgrupper:
- Radiografisk aksial spondylatropati (r-axSpA) aka ankyloserende spondylitt (AS) aka Morbus Bechterew
- non-radiografisk aksial spondylartropati (nr-axSpA)
Det kan komme som en overraskelse for mange at prevalensen av alle former for SpA er opptil 2 % av den generelle befolkningen i de fleste deler av verden, med noen geografiske forskjeller basert på genetiske forskjeller i befolkningen. Merk at SpA er en samlebetegnelse for alle sykdomskategoriene og lemper en rekke forskjellige pasienter inn i samme boks, slik at prevalensen blir noe høyere enn hva man kanskje kunne anta. Allikvel, og til sammenligning, er prevalensen av revmatoid artritt – bedre kjent som leddgikt – omtrent 1 % av den generelle befolkningen. RA er derimot en mer populærvitenskapelig diagnose, som får mer oppmerksomhet både blant klinikere og den generelle befolkningen. Noe av årsaken til manglende gjenkjennelse av spondylatrittene er manglende konkretisering av de mange forskjellige manifestasjonene opp gjennom den moderne medisinske historien. Man har arkeologiske funn tilbake til det femte århundre e.Kr som viser skjelettfunn forenlig med det som i dag betraktes som ankyloserende spondylitt, noe som viser hvordan inflammatoriske ryggsmerter etter alt å dømme har hjemsøkt menneskerasen gjennom titusenvis av år. Allikevel gikk det frem til 1960-tallet før man fikk de første kriteriene for sykdommen (Roma Kriteriene). På 70-tallet ble SpA atskilt fra revmatoid artritt gjennom seronegative for RA-antistoff, og man fant linken mellom vevstypen HLA-B27 og inflammatoriske ryggsmerter. Calin og kollegaer [5] utviklet de første kriteriene for «inflammatorisk ryggsmerte» (IBP) for å hjelpe klinikere å skille det, gjennom pasienthistorie, fra degenerative eller mekaniske ryggsmerter. I 1984 ble de modifiserte New York (mNY) kriteriene for klassifisering av AS publisert, som forankret sykdommen i radiografisk synlig IS-leddsaffeksjon sammen med flere kliniske trekk. Siden den gang, spesielt med introduksjonen av avansert bildeteknologi som MR, bredere anvendelse av genetisk testing og økt bevissthet omkring et bredere spekter av kliniske presentasjoner som representerer SpA, har ulike oppdaterte klassifiseringskriterier blitt fremmet. I 2009 publiserte Assessment of SpondyloArthritis International Society (ASAS) klassifiseringskriterier for AxSpA, som fortsatt er gjeldende [6]. ASAS-kriteriene reflekterer en mer klinisk praktisk erkjennelse av at pasienter med SpA har en tendens til å ha enten overveiende aksiale manifestasjoner eller overveiende perifere trekk, inkludert perifer artritt, entesitt og daktylitt, selv om de erkjenner at overlapping kan forekomme. Pasienter med AxSpA kan enten ha klassiske røntgenforandringer i IS-leddene (f.eks. periartikulær sklerose, innsnevring av ledd, erosjoner, ankylose) eller MR-forandringer i samsvar med betennelse i IS-leddene (periartikulært benødem). Diagnosen axSpA settes derfor på bakgrunn av flere/mange tegn, hvor man ved definitive radiologiske forandringer i IS-leddene (altså på et normalt røntgenbilde) kaller dette for radiologisk ax-SpA (r-axSpA), som er ensbetydende med mNY kriteriene for ankyloserende spondylitt (og/eller Mb Bechterew på folkemunne).
Man rapporterer forskjellige prevalenstall i forskjellige deler av verden, og gjerne høyere prevalens i Nord-Europa. Dette er sannsynligvis grunnet høyere forekomst av vevstypen HLA-B27 i de nordiske landene [7]. Det er rapportert en forekomst på mellom 0.3%-1.4% av axSpA på verdensbasis [4]. I Europa er forekomsten av HLA-B27 ca. 8% i befolkningen, og forekomsten av vevstypen synker drastisk i Asia og Afrika. Allikevel er det viktig å påpeke at på tross av at forekomsten av HLA-B27 er høy i Norden, vil <10% av pasienter med vevstypen utvikle spondyloartritt [4,8].
Samme spektrum eller to distinkte tilstander?
Etter at ASAS kriteriene ble publisert i 2009, har vår kunnskap omkring axSpA økt betraktelig. Introduksjonen av et nytt klassifikasjonssystem, gjorde at inklusjonen av pasienter med mindre uttalte symptomer og negative røntgenfunn kunne bli inkludert i kliniske studier. Dette har medført at man i 2023 vet mye mer om disse pasientene nå enn når klassifikasjonskriteriene ble publisert. Når man på slutten av 90-tallet forstod at mange pasienter kunne ha positiv sacroilitt på MR, men fravær av røntgenfunn, innså man også at dette var en annen kategori spondyloartrittpasienter. Men man visste ikke om nr-axSpA skulle betraktes som en distinkt sykdomsgruppe eller om denne «nye gruppen» med pasienter representerte tidlig ankyloserende spondylitt. Etter hvert som forskningen tiltok på 2010-tallet har man nå forstått at mange pasienter som klassifiseres som nr-axSpA aldri vil progrediere til at funnene er synlige på røntgen. Allikevel viser studier at en stor andel pasienter (kanskje så mye som 50%) vil i løpet av livet progrediere til å få synlige forandringer i IS-leddene på røntgen. Dog er dette en del av feltet som ikke er helt ut forstått da langtidsstudier mangler. I tillegg har fremveksten av biologiske legemidler gjort at man antar at progresjonen av de strukturelle funnene i stor grad kan stoppes hos en andel av pasientene. Det som dog er viktigere klinisk er at gruppene i stor grad er like når det kommer til sykdomsbyrde [9-12].
Feilaktige premisser
Forståelsen vår av spondyloartritt har økt kraftig de siste tyve årene. Det at man tidligere beskrev diagnosestillelsen som «uheldig» eller «uflaks» med lite til ingen betydning for individet da man allikevel ikke hadde noen effektive medikamenter, har nok i stor grad gjort pasienter (og helsepersonell) en bjørnetjeneste. Et lavpraktisk, men like fullt illustrativt eksempel på dette er å gjøre et google bildesøk på «Mb Bechterew» eller «axial spondyloarthritis». Da får man opp en myriade av bilder av godt voksne/eldre menn med hyperkyfosert torakalcolumna og redusert funksjonsnivå. I dag vet vi at de fleste pasienter ikke passer inn i dette bildet. Eksempelvis er forekomsten av axSpA ganske likt fordelt mellom kjønnene. De fleste får diagnosen stilt tidlig i løpet av 20-årene, og tidlig diagnosestillelse vil medføre (mer) effektiv behandling og håndtering, samt gode sjanser for å leve et godt og fullverdig liv med tilstanden. Det er sågar eksempler i Norge på toppidrettsutøvere som lever, og presterer godt, med diagnostisert spondyloartritt.
Diagnoseforsinkelse
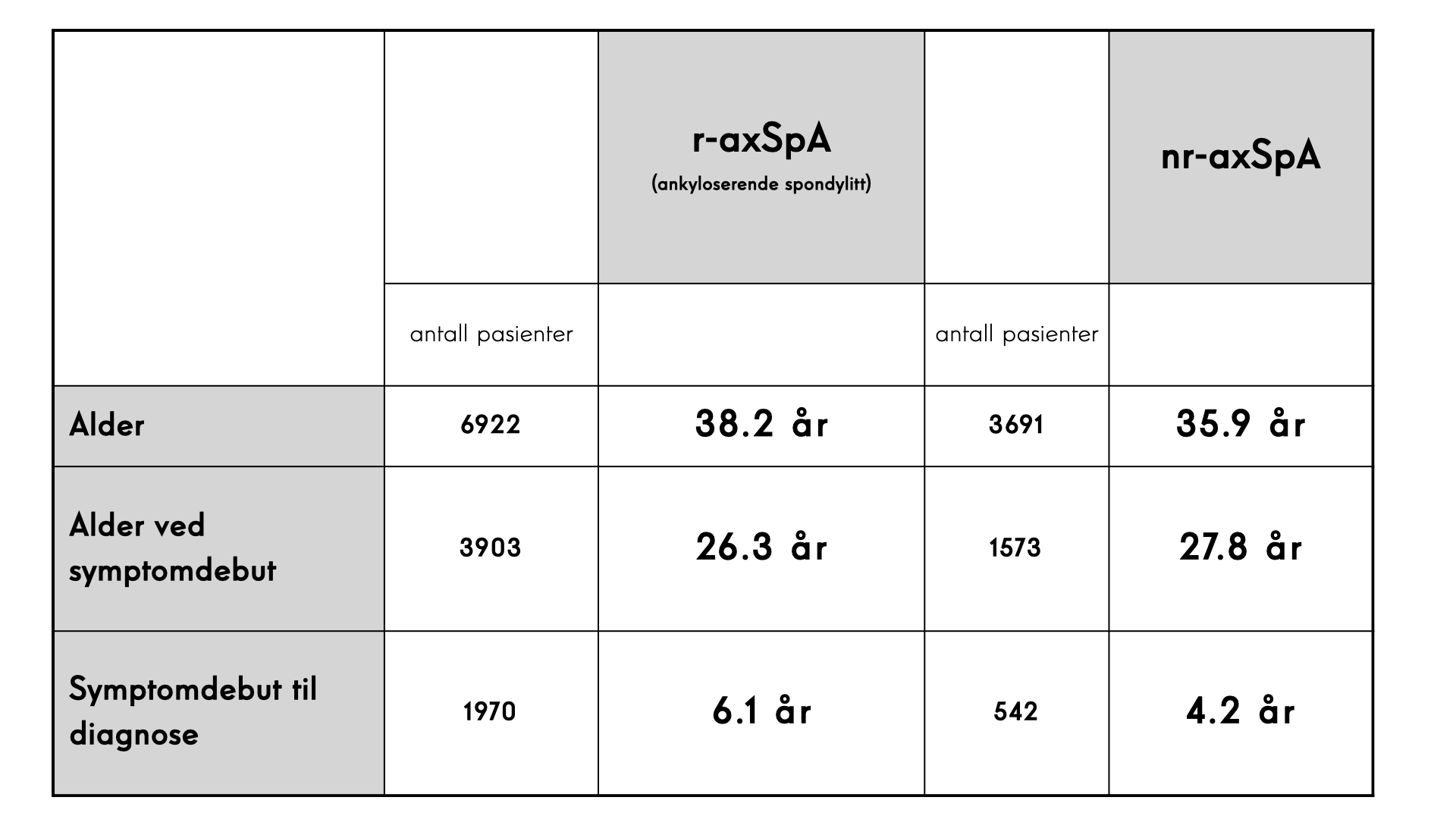
Det er dessverre fortsatt stor grad av diagnoseforsinkelse på denne pasientgruppen. Uavhengig av om pasienten har r-axSpA eller nr-axSpA er diagnoseforsinkelsen mellom 5 og 10 år [13,14], dog med fallende tendens senere år som kan tyde på noe mer årvåkenhet rundt diagnosen. De fleste har hatt symptomer i >5 år, og mange har hatt symptomer i >10-15år før de får diagnosen. Dette har åpenbar stor individuell betydning for pasienten, og er en samfunnsøkonomisk og -medisinsk byrde i sin helhet.
Kompetansemangel
Som nevnt har vårt helsevesen tradisjonelt vært, og mange vil mene at det fortsatt er, hierarkisk basert. Det er dog godt dokumentert at kompetansemangelen ikke er begrenset til ikke-medikamentelle klinikere i førstelinjen, men det foreligger masse dokumentasjon som belyser forsinkelse, feildiagnostisering, feilmedisinering, over- og feilbehandling fra førstelinje-leger, fastleger og spesialister [15-17]. Mange pasienter med revmatiske ryggsmerter blir feilaktig diagnostiert med enten psykosomatikk, fibromylagi og/eller ME/CFS.
Klinikken
Det som burde være åpenbart er at dette ikke er pasienter vi vil se ofte. Samtidig bør man være obs på at det dette er pasienter som har tidlig symptomdebut, behandlingsresistente smerter, mye smerter over lang tid, typisk et tydelig klinisk mønster (inflammatoriske ryggsmerter) og vil sannsynligvis henvende seg til mange forskjellige helsepersonell i håp om symptomlindring og funksjonsbedring. Enkelte studier peker på at kanskje så mye som 5% av langvarige ryggpasienter i en «ryggpopulasjon» har inflammatorisk betingede symptomer [18].
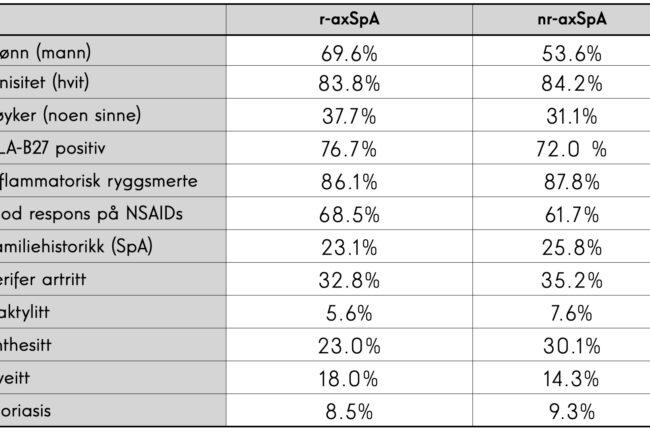
Man har tradisjonelt hatt en antagelse om at det er primært menn som rammes av tilstanden aksial spondyloartritt, spesielt ankyloserende spondylitt har vært antatt å være en predominerende mannlig sykdom. Tidligere opererte man med 3:1 forhold, men en større gjennomgang fra 2019 viser at andelen menn er forskjellig avhengig av diagnose [14]. Av >8400 pasienter med r-axSpA (altså ankyloserende spondylitt) er 69% menn, mens i en populasjon av >4000 pasienter med nr-axSpA er 53% av pasientene menn. Med andre ord tyder det fortsatt på at den tradisjonelle formen for AS har overvekt av menn med diagnosen, mens det er mer jevnt fordelt på den nyere tilstanden nr-axSpA.
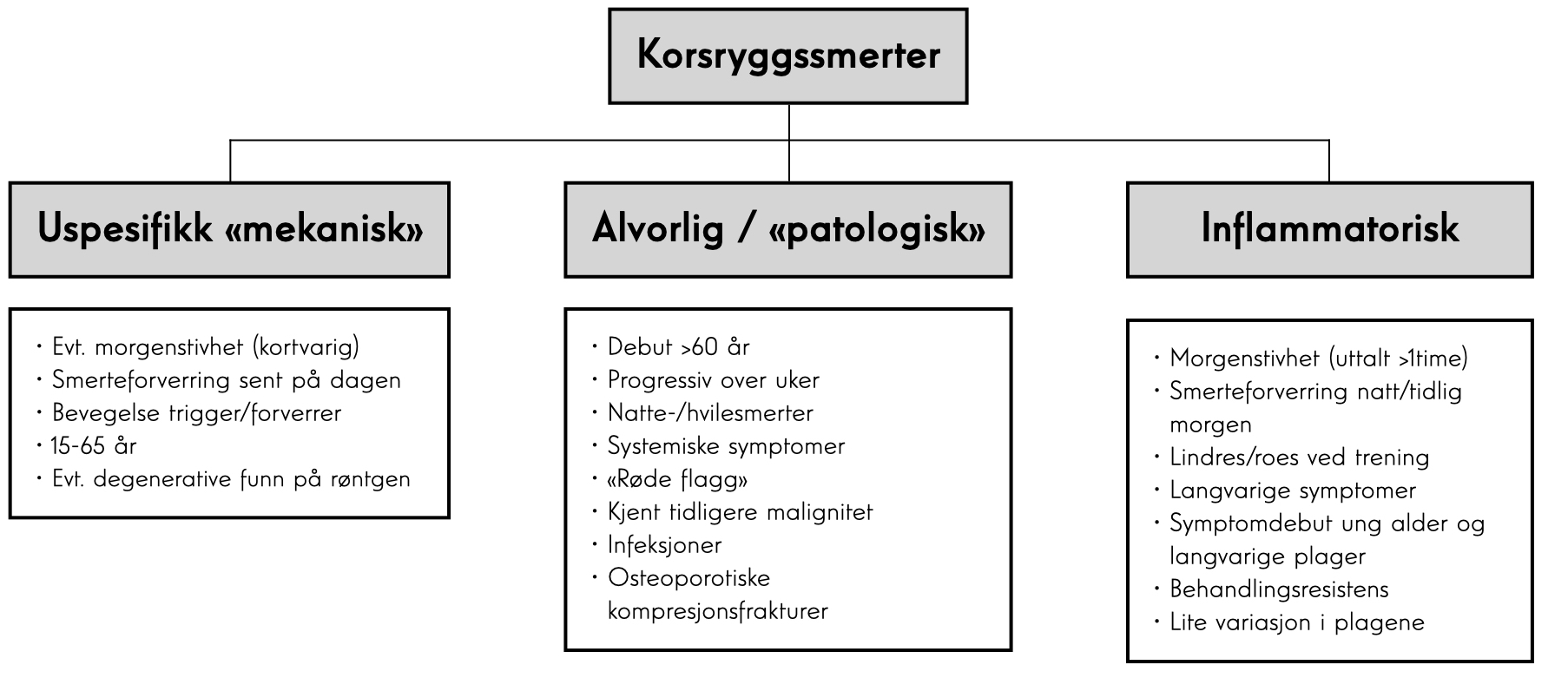
Inflammatorisk ryggsmerte er en hjørnestein klinikeren bør være klar over (se boks). De aller fleste pasientene (opp mot 90% av diagnostiserte r-axSpA og nr-axSpA pasienter) utfyller de fleste av kriteriene for inflammatorisk ryggsmerte. Over 80% av pasientene uavhengig av diagnose er hvite og majoriteten av pasientene er HLA-B27 positive. De fleste pasientene (>60%) responderer godt på NSAIDs, mens familiær disposisjon (det vil si førsteleddsslektning med diagnostisert axSpA) er tilstede i omkring 25% av tilfellene. Det er også en del øvrige funn verdt å bemerke seg som er tilgjengelig i tabellen.
Diagnose
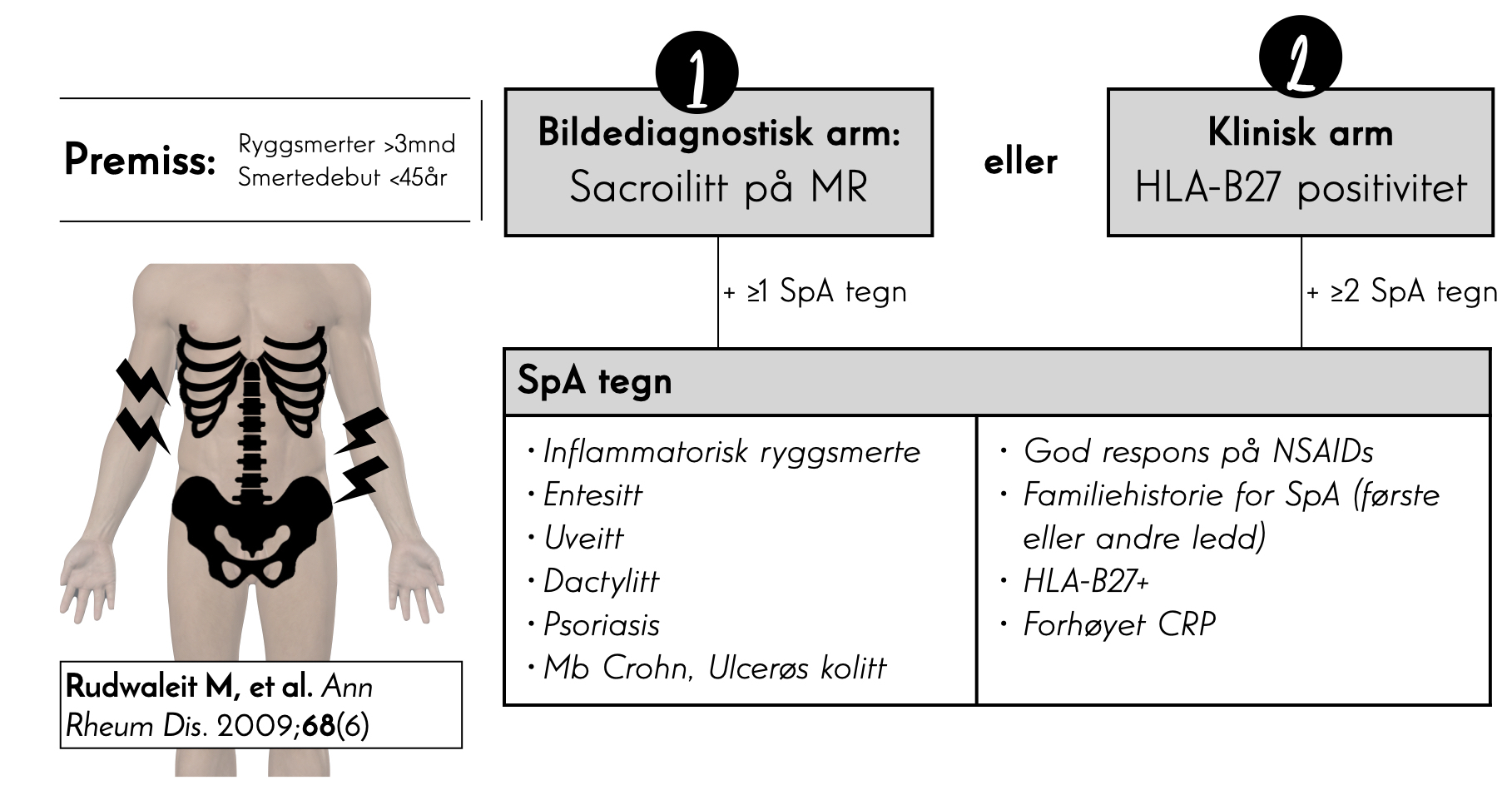
Ved mistanke om spondylatritt, må man være klar over at diagnostikken hviler på èn av to «armer» (se illustrasjonsbildet). Den sterkeste indikatoren er MR-verifisert sacroilitt (den «bildediagnostiske armen»), som medfører at man kun behøver ett ekstra SpA tegn for å bli klassifisert som axSpA. Den «kliniske armen» baserer seg på positiv HLA-B27 vevstype + to ekstra SpA-tegn. Av tabellen ser vi at majoriteten av pasienter som diagnostiseres med SpA har HLA-B27 positivitet (opp mot 90%. Dersom man finner denne positiv, men ikke finner objektiv sacroilitt på MR, kan pasienten likevel altså henvises, men erfaringsmessig er det noe vanskeligere å få satt diagnosen hos denne pasientgruppen.
Sacroilitt er en MR diagnose, og klinikeren(henviseren) bør være klar over at man må presisere å få IS-leddsbilder på MR sekvensen hvis man henviser til bildediagnostikk. Hvis ikke vil man få normale korsryggsbilder som ikke inkluderer IS-ledd, og man får altså ikke foretatt en adekvat vurdering.
Behandling og prognose
Når det gjelder behandling og rehabilitering av pasienter med spondyloartritt, er det hevet over enhver tvil at bevegelighet og trening er en hjørnestein i langvarig håndtering av plagene. Det er dog også åpenbart at vår viktigste rolle i dette bildet er nettopp å ikke overse pasienten med spondyloartritt, da mange har svært redusert livskvalitet og en hverdag preget av mye smerter og funksjonsnedsettelse i årevis før diagnosen blir satt. Etter at diagnosen foreligger kan man litt flåsete si at de fleste av disse pasientene får et nytt og bedre liv. Ikke minst hjulpet frem av betennelsesdempende medikamenter (NSAIDs), anti-revmatiske legemidler populært kalt dMARDS (disease modifying antirheumatic drugs) og i senere tid biologiske legemidler som ikke kan betraktes som noe annet enn en revolusjon for pasienter med spondyloartritt [19]. Velhåndtert og velmedisinert, vil mange pasienter få muligheten til å komme tilbake til meningsfylt (og ofte intens) trening og bevegelse, i en hverdag som tidligere har vært preget av smerter og ubehag spesielt etter aktivitet. Etter at diagnosen foreligger er det vår rolle å veilede i adekvat kondisjons- og styrketrening, men forskjellige manuelle behandlinger for symptomlindring og funksjonsbedring kan også være aktuelt hos mange.
Medikamentell behandling håndteres normalt sett i spesialisthelsetjenesten, eventuelt i tett samarbeid med pasientens fastlege. Langtidseffektene på biologisk behandling er enda ikke godt dokumentert, men mye peker i retningen av at håndteringen av spondyloartritt i dag fungerer godt, og majoriteten av pasientene lever godt med sykdommen [20,21].
Avslutningsvis ønskes det igjen å understreke klinikerens rolle som diagnostiker med diagnostisk ansvar i møte med denne pasienten. Forskningen er klar på at man som kliniker ikke lenger kan hvile seg på andres kompetanse og anta at disse pasientene plukkes opp på legekontorer og/eller spesialisthelsetjenesten. Som fysioterapeut ser, og antageligvis overser, man mange flere av disse pasientene enn man skulle tro, og det er denne forfatterens håp at dagens artikkel skal gjøre klinikeren mer obs på dette og årvåken i det neste møtet med pasienten med langvarige korsryggsplager.
REFERANSER:
1. Maher C, et al. Non-specific low back pain. Lancet. 2017;389(10070):736-47.
2. Balague F, et al. Non-specific low back pain. Lancet. 2012;379(9814):482-91.
3. Deyo RA, Weinstein JN. Low back pain. N Engl J Med. 2001;344(5):363-70.
4. Sieper J, Poddubnyy D. Axial spondyloarthritis. The Lancet. 2017;390(10089):73-84.
5. Calin A, et al. Clinical history as a screening test for ankylosing spondylitis. JAMA. 1977;237(24):2613-4.
6. Rudwaleit M, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis. 2009;68(6):777-83.
7. Bakland G, Nossent HC. Epidemiology of spondyloarthritis: a review. Curr Rheumatol Rep. 2013;15(9):351.
8. Braun J, Sieper J. Ankylosing spondylitis. Lancet. 2007;369(9570):1379-90.
9. Baraliakos X, Braun J. Non-radiographic axial spondyloarthritis and ankylosing spondylitis: what are the similarities and differences? RMD Open. 2015;1(Suppl 1):e000053.
10. Kiltz U, et al. Do patients with non-radiographic axial spondylarthritis differ from patients with ankylosing spondylitis? Arthritis Care Res (Hoboken). 2012;64(9):1415-22.
11. Sieper J, van der Heijde D. Review: Nonradiographic axial spondyloarthritis: new definition of an old disease? Arthritis Rheum. 2013;65(3):543-51.
12. Wallis D, et al. Ankylosing spondylitis and nonradiographic axial spondyloarthritis: part of a common spectrum or distinct diseases? J Rheumatol. 2013;40(12):2038-41.
13. Jones A, et al. Time to diagnosis of axial spondylarthritis in clinical practice: signs of improving awareness? Rheumatology (Oxford). 2014.
14. Lopez-Medina C, et al. Characteristics and burden of disease in patients with radiographic and non-radiographic axial Spondyloarthritis: a comparison by systematic literature review and meta-analysis. RMD Open. 2019;5(2):e001108.
15. van Onna M, et al. General practitioners’ perceptions of their ability to identify and refer patients with suspected axial spondyloarthritis: a qualitative study. J Rheumatol. 2014;41(5):897-901.
16. Brandt HC, et al. Performance of referral recommendations in patients with chronic back pain and suspected axial spondyloarthritis. Ann Rheum Dis. 2007;66(11):1479-84.
17. Jois RN, et al. Recognition of inflammatory back pain and ankylosing spondylitis in primary care. Rheumatology (Oxford). 2008;47(9):1364-6.
18. Jordan CL, Rhon DI. Differential diagnosis and management of ankylosing spondylitis masked as adhesive capsulitis: a resident’s case problem. J Orthop Sports Phys Ther. 2012;42(10):842-52.
19. Callhoff J, et al. Efficacy of TNFalpha blockers in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis: a meta-analysis. Ann Rheum Dis. 2014.
20. Mease PJ. Suspecting and Diagnosing the Patient with Spondyloarthritis and What to Expect from Therapy. Med Clin North Am. 2021;105(2):325-39.
21. Ramiro S, et al. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis. 2023;82(1):19-34.