Artrose er èn av de tilstandene som vi møter hver eneste dag i klinisk praksis, og som etter tid og stunder utvikler seg til å være en del av dagligtalen vår. Men hva kan vi egentlig om artrose? Hva skjer på systemnivå? Hva skjer i leddet? Er artrose noe som bare rammer leddbrusken, eller er det flere strukturer involvert? I denne artikkelen går vi i dybden og besvarer noen av disse spørsmålene.
Artrose er den vanligste formen for leddsykdom og er en hovedårsak til smerte og funksjonshemming hos voksne. Ofte blir artrose referert til som en degenerativ leddsykdom, men dette er en feilbetegnelse fordi artrose ikke bare kan anses som «slitasje over tid», men snarere unormal ombygging av vevsstrukturene drevet av en rekke inflammatoriske mediatorer i det berørte leddet. Derfor forsøker man også å bevege seg vekk fra begrepet «slitasje» og «slitasjegikt», og heller bruke det generiske begrepet «artrose». Det kanskje mest åpenbare startpunktet når vi skal diskutere hva artrose er for noe, er å understreke at artrose er en revmatisk leddsykdom. Det overrasker mange at artrose havner i det revmatologiske spekteret, men samtidig har artrose mange fellestrekk og kliniske karakteristika vi kjenner fra andre revmatiske sykdommer. Derfor er artrose en form for revmatisme på samme måte som revmatoid artritt, spondyloartritt, systematisk lupus erythematosus, urinsyregikt, systematisk sklerose og mange andre. Prevalensen av artrose er derimot mye høyere enn mange av de nevnte, og fortjener således større og mer omfattende spalteplass. Denne økte oppmerksomheten har kanskje også medført at mange betrakter artrose som en selvstendig sykdomskategori, i stedet for den revmatologiske sykdommen den tross alt er.
Whole organ disease
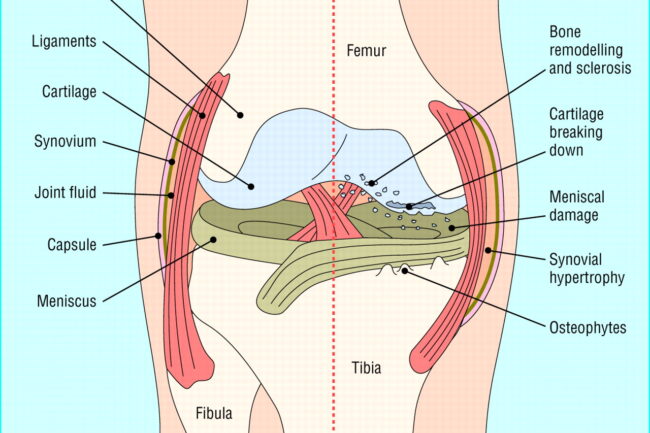
Artrose må anses som en sykdom som rammer hele leddet og har systemiske effekter som påvirker hele individet
Artrose er en leddsykdom som rammer hele leddet, og betegnes i litteraturen som en «whole organ disease», hvor organet er leddet i sin helhet. Sykdommen involverer strukturelle endringer i hyalin leddbrusk, subkondralt benvev, leddbånd, leddkapsel, synovium og periartikulære muskler. Den komplekse patogenesen av artrose involverer mekaniske, inflammatoriske og metabolske faktorer, som til slutt fører til strukturell ødeleggelse og funksjonsbrist i leddet som er affisert. Sykdommen er en dynamisk endring som oppstår etter en ubalanse mellom reparasjon og ødeleggelse av leddvev, og ikke en passiv degenerativ sykdom eller såkalt slitasjesykdom som ofte beskrevet [1-3]. Det er også disse endringene i fellesskap, og ikke enkeltvis, som medfører at artrose utgjør den store sykdomsbyrden. Det skjer store, cellulære endringer i hele leddet, og det er nyttig å kunne litt om de enkelte bestanddelene for å forstå artroseprosessen bedre.
Leddbrusken
Normal voksen leddbrusk består av ekstracellulær matrix (vann, kollagen, proteoglykaner og en svært liten komponent av kalsiumsalt) og kondrocytter . Omsetningshastigheten av kollagen er relativt langsom, mens proteoglykanomsetningen er rask [13]. Den normale omsetningen av disse matrikskomponentene gjøres av kondrocyttene, som syntetiserer disse komponentene og de proteolytiske enzymene som er ansvarlige for deres nedbrytning. Kondrocytter er i sin tur påvirket av en rekke faktorer, inkludert polypeptidvekstfaktorer og cytokiner, strukturelle og fysiske stimuli og til og med komponentene i selve matrixen. Artrose skyldes at kondrocytter ikke opprettholder homeostase mellom syntese og nedbrytning av disse ekstracellulære matrikskomponentene. Det er ikke kjent hva som initierer ubalansen mellom nedbrytning og reparasjon av brusk. Traumer som forårsaker mikrofraktur eller betennelse som forårsaker en liten økning i enzymaktivitet kan tillate dannelsen av «slite»-partikler, som deretter kan bli oppslukt av residente makrofager. På et tidspunkt overvelder produksjonen av disse «slitasje»-partiklene evnen til å eliminere dem og de blir mediatorer av betennelse, og stimulerer kondrocytten til å frigjøre nedbrytende enzymer. Molekyler fra nedbrytning av kollagen og proteoglykan, også tatt opp av synoviale makrofager, forårsaker frigjøring av proinflammatoriske cytokiner, som TNFα, IL-1 og IL-6. Disse cytokinene kan binde seg til kondrocyttreseptorer som fører til ytterligere frigjøring av metalloproteinaser og hemming av type II kollagenproduksjon, og dermed øke brusknedbrytningen. Denne forstyrrelsen av homeostase resulterer i økt vanninnhold og redusert proteoglykaninnhold i den ekstracellulære matrixen, svekkelse av kollagennettverket på grunn av redusert syntese av type II kollagen og økt nedbrytning av allerede eksisterende kollagen.
Innledende degenerative endringer i leddbrusken fører til bruskmykning, fibrilleringssone i de overfladiske lagene, fissurering og redusert brusktykkelse. Disse endringene blir mer uttalt med tiden, når leddbrusken tynnes ut til total ødeleggelse, og til slutt etterlater den underliggende subkondrale benplaten fullstendig eksponert.
Subkondralt benvev
Det er foreløpig ikke klart om endringer i subkondralt benvev foregår før endringene leddbrusken eller om de skjer som et ledd i sykdomsprogresjonen, sekundært til tilpasningsprosesser etter endringer i de biomekaniske egenskapene til den overliggende leddbrusken. De to prosessene er uansett nært beslektet, og foregår i tett relasjon til hverandre. Subkondralt ben består av den subkondrale benplaten og det underliggende trabekulære ben- og benmargsrommet. Den subkondrale benplaten består av kortikalt bein og er atskilt fra leddbrusken av sonen med forkalket brusk. Subkondrale benegenskaper modifiseres gjennom den cellemedierte prosessen med remodellering og modellering [8]. Under artroseprosessen kan alle disse mekanismene endres på et tidspunkt, noe som resulterer i subkondrale benstrukturendringer. Endringer i benet inkluderer sklerotiske forandringer og utvikling av benmargslesjoner som kan visualiseres på MR. Dermed er det en progressiv økning i den subkondrale benplatens tykkelse, en modifikasjon i arkitekturen til subkondralt trabekulært ben og dannelse av nytt bein ved leddkantene, kjent som osteofytter. Subkondral benslitasje kan være forårsaket av endret mekanisk belastning som resulterer i subkondral ombygging og er assosiert med samtidige benmargsskader. Benslitasje vurderes ved konvensjonell radiografi som tap av bentetthet eller ved MR som utflating/depresjon av artikulær cortex. MR-studier har vist at disse beinlesjonene i seg selv er assosiert med utvikling og forverring av brusktap. Benmargslesjoner er degenerative lesjoner som består av ødem, benmargsnekrose, fibrose og trabekulære abnormaliteter. De er en markør for økt metabolsk aktivitet og deres forekomst er assosiert med lokal bruskskade.
Synovialmembranen
Synoviale inflammatoriske infiltrater er identifisert hos mange artrosepasienter, selv om de generelt er av lavere grad enn de som er observert ved revmatoid artritt. Nyere histologiske undersøkelser viser at synovitt oppstår selv i tidlige stadier av artrosen. Spesifikke aspekter ved synovial betennelse, som antall infiltrerende makrofager, kan være høyere ved tidlig sykdom, men prevalensen av synovitt øker med fremskreden sykdom. Til tross for lavere alvorlighetsgrad og større variasjon i artrose-assosiert synovitt sammenlignet med RA, har mange grupper rapportert at lavgradig synovitt er assosiert med sykdomsmanifestasjoner. En sammenheng mellom synovitt og symptomer ble først notert av Torres og kollegaer [4] som viste at synovitt, meniskrupturer og benmargslesjoner påvist ved MR alle korrelerte med symptomer. Andre har rapportert at endring i smerteskår over tid varierte med endring i synovitt, noe som tyder på en årsakssammenheng. Det har også blitt sammenheng mellom synovitt og knesymptomer som eksisterer selv hos pasienter uten radiografisk tegn på artrose [5].
Menisker og leddbånd
Patologiske endringer i menisker og leddbånd er vanlige hos personer med artrose i knær. Det er godt etablert at skade på menisken og/eller leddbåndene predisponerer for utvikling av artrose, og MR-studier har avdekket endringer selv hos individer uten kjent historie med traumeforandringer. Meniskskade oppstår hos 63 % av voksne med symptomatisk kneartrose og i en longitudinell studie hadde symptomatiske personer med signifikant meniskskade en oddsratio på 7,4 for utvikling av radiografisk kneartrose 30 måneder senere (45). Likeledes er skade på fremre korsbånd (ACL) vanlig hos eldre voksne med kneartrose. I en MR-studie hadde 22,8 % av personer med symptomatisk kneartrose tegn på komplett ACL-ruptur, men mindre enn halvparten av dem oppga traumer i anamnesen. De patologiske endringene i meniskene forbundet med både aldring og artrose, likheter med endringer som er sett i leddbrusken, inkludert matrixforstyrrelser, fibrillering, celleklynger, forkalkning og celledød. En økning i vaskulær penetrasjon ledsaget av økt sensoriske nervetetthet er observert hos artrotiske menisker, noe som kan relateres til meniskenes evne til å være smertegivende ved kneartrose.
Ny innsikt i patogenese og smerteforståelse ved artrose
Under artroseprosessen endres brusksammensetningen og brusken mister sin integritet. Sykdommen endrer bruskmaterialets egenskaper og øker dens sårbarhet for fysiske krefter. I utgangspunktet er erosjoner bare på overflaten, men dette etterfølges av mer dype bruskfissurer. I et forsøk på reparasjon viser de hypertrofiske kondrocyttene økt syntetisk aktivitet, som igjen medfører nedbrytningsprodukter i extracellulær matrix og proinflammatoriske mediatorer. Disse deregulerer kondrocyttfunksjonen og virker på det tilstøtende synovium for å stimulere proliferative og pro-inflammatoriske responser. Prolifererende synoviocytter frigjør også proinflammatoriske produkter; denne prosessen er ledsaget av vevshypertrofi og økt vaskularitet. I det subkondrale beinet økes beinomsetningen, og vaskulær invasjon finner sted, som går fra det subkondrale benet. Denne benremodelleringen og -reparasjonen er også assosiert med utviklingen av subkondrale benmargslesjoner. Osteofyttene som utvikler seg ved leddkantene gjennom reaktivering av endokondral ossifikasjon er sterkt påvirket av inflammatoriske biologiske faktorer, men også av overbelastning og unormal leddkinematikk. Artrose beskrives typisk som en heterogen sykdom med et bredt spekter av underliggende veier, som fører til lignende utfall av ledddestruksjon. I denne sammenheng kan artrose betraktes som et syndrom snarere enn en enkelt sykdom. Hver av de vanlige risikofaktorene for artrose kan forårsake en annen mekanistisk vei som fører til slitasjegikt, slik at mediatorene som fremmer utviklingen av artrose hos eldre voksne kan være forskjellige fra de som fremmer slitasjegikt etter en leddskade i en yngre voksne eller hos overvektige individer.
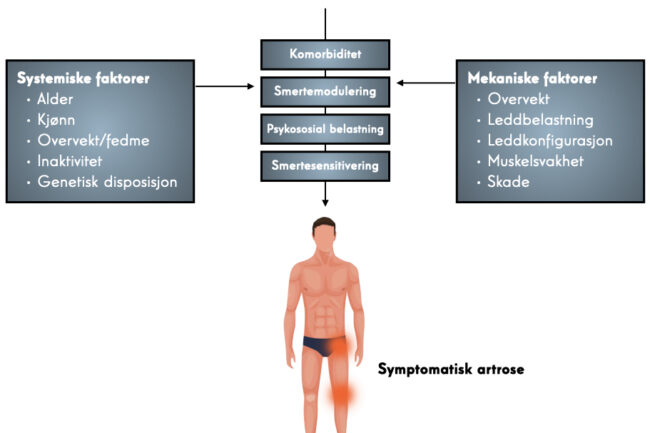
Artrose må anses som en sykdom som rammer hele leddet og har systemiske effekter som påvirker hele individet
Pasienter med artrose opplever smerte som det mest invalidiserende symptomet. Morgenstivhet, redusert bevegelsesutslag, krepitus, leddinstabilitet (knekking eller svikt), hevelse, muskelsvakhet, tretthet og smerterelatert psykologisk plage ses også ofte hos pasienter med artrose. Smerten ved kneartrose er typisk en intermitterende og hovedsakelig vektbærende (mekanisk) smerte. Ofte er de intermitterende smertene forutsigbare, men når de blir mer alvorlige, hyppigere eller uforutsigbare, kategoriserer pasientene oftere smertene sine som uakseptable.
Tradisjonell bildediagnostikk med røntgen viser kun moderate assosiasjoner mellom strukturell artrose og tilstedeværelse av smerte hos affiserte individer. Strukturell artrose vurdert med MR viser tilsvarende moderate assosiasjoner med tilstedeværelse av leddsmerter. Sammenhengen mellom strukturell artrose på røntgen og smerte blir mye mer tydelig hvis man ser på hyppige smerter i stedet for sjeldne smerter, og ved mer alvorlig strukturell artrose i stedet for mindre alvorlige tilfeller.
Bortsett fra perifere nociseptive smertemekanismer, ser det ut til å være smertesensibilisering ved hjelp av nevropatiske smertemekanismer eller sentrale smertemekanismer tilstede hos en stor andel av pasienter med artrose.
En metaanalyse av smertesensibilisering hos pasienter med artrose, målt objektivt ved kvantitativ sensorisk testing (QST), viste at pain-pressure thresholds (på det berørte stedet, men også fjerntliggende steder), temporal summation og betinget smertemodulering var forskjellig mellom pasientene og friske kontroller. Denne metaanalysen viste også at hos pasienter med kneartrose med høy symptomalvorlighet var pain pressure thresholds lavere enn hos pasienter med lav symptomalvorlighet. Fra selvrapporterte spørreskjemaer for screening av nevropatisk smerte som painDETECT, estimerte en metaanalyse at 23 % av pasientene med slitasjegikt sannsynligvis hadde en form for nevropatisk smerte.
Epidemiologi, byrde og risikofaktorer
Anatomisk og strukturelt kan hvilket som helst synovialt ledd prinsipielt rammes av artrose. Klinisk er det dog tre ulike steder som utmerker seg; kne, hofte og hånd (i synkende rekkefølge). Det er også her hvor forskningsmengden er størst og likeledes vår kunnskap. Samlet sett indikerer dataene mye høyere prevalens for radiografisk artrose enn for symptomatisk artrose, og for kne- og hofteartrose, enn for håndartrose. I 2012 var andelen av befolkningen i alderen ≥45 med legediagnostisert artrose 26,6 % (menn 22,4 %, kvinner 30,5 %). De vanligste lokalisasjonene var kne (13,8 %), hofte (5,8 %) og hånd (3,1 %). Innen år 2032 anslås andelen av befolkningen i alderen ≥45 med legediagnostisert artrose å øke fra 26,6 % til 29,5 % (hvor som helst), fra 13,8 % til 15,7 % for kneet og 5,8–6,9 % for hoften [6]. Kneartrose står for omtrent 85 % av sykdomsbyrden av artrose på verdensbasis. Når det gjelder funksjonsbegrensning, var artrose og diabetes mellitus ansvarlig for den største økningen i år levd med uførhet (Years Lived with Disability – YLD) på globalt nivå, i forhold til de andre topp 20 årsakene til funksjonshemming. Byrden av artrose på verdensbasis forventes å vokse å være den fjerde ledende årsaken til år levd med funksjonshemming innen 2030.
Alder er en av de mest åpenbare risikofaktorene for artrose. Den økende forekomsten av artrose med alderen er et resultat av kumulativ eksponering for ulike risikofaktorer og biologiske aldersrelaterte endringer i leddstrukturene. For kneartrose eksisterer en rekke moderate til sterke risikofaktorer; kvinnelig kjønn, fedme og tidligere kneskade. For hofteartrose er risikofaktorer som kvinnelig kjønn og fedme mindre uttalt, men hoftedeformiteter som CAM-deformitet eller acetabulær dysplasi øker risikoen moderat til sterkt. CAM-deformitet og mild dysplasi øker risikoen for artrose spesielt i middelaldrende ( 55–65 år), men ikke i den eldre befolkningen (65 år og eldre), mens alvorlig dysplasi er sterkt assosiert med hofteartrose og fører til utvikling i tidlig alder (<50 år). Tunge arbeidsaktiviteter er risikofaktorer for både hofte- og kneartrose; sysselsetting i oppdrett eller anleggsnæringen er spesielt assosiert med hofteartrose, og arbeid som involverer hyppige knelende og tunge løft er assosiert med kneartrose. Flere idretter med høy intensitet og/eller kontakt (f.eks. fotball, håndball, hockey, bryting, vektløfting og langdistanseløp) har blitt rapportert som moderat til sterkt assosiert med økt risiko for hofteartrose og/eller kneartrose, ofte med en dose -responsavhengighet. For kneartrose er den økte risikoen ved sport delvis på grunn av kneskader (som er en risikofaktor i seg selv) og for hofteartrose kan risikoen være assosiert med tilstedeværelsen av CAM-deformitet, som kan utvikle seg under idrettsaktive ungdommer.
Bidraget fra genetikk ved artrose er beregnet til å være mellom 40 % og 80 %, med et sterkere genetisk bidrag i hånd- og hofteartrose enn ved kneartrose.
Artrose som en «systemtilstand»
Metaanalyser viser en liten økt risiko for utvikling av hjerte- og karsykdom blant pasienter med artrose sammenlignet med personer som ikke har artrose. I tillegg ble tilstedeværelsen av artrose funnet å resultere i en noe økt risiko for kardiovaskulær død hos pasienter sammenlignet med personer som ikke har artrose. Mange pasienter med artrose, spesielt eldre pasienter (65 år og eldre), vil ha èn eller flere komorbiditeter. Et sammendrag av fire australske studier viste at over halvparten av de eldre pasientene med artrose hadde hypertensjon, etterfulgt av kardiovaskulær sykdom (20 %), dyslipidemi (19 %), diabetes (14 %) og psykiske lidelser inkludert depresjon (12 %) [7]. Metaanalyser viser at èn eller flere av slike komorbiditeter eller andre kroniske sykdommer, som diabetes eller hjerte- og karsykdommer, vil predikere raskere forverring av smerte og raskere forverring i sykdomsbyrden hos pasienter med artrose.
Diagnostikk og rollen til bildediagnostikk
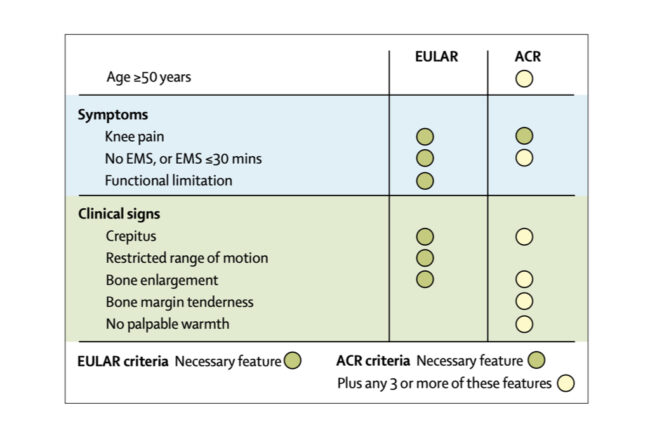
Forskjellige klassifikasjonskriterier for artrose EULAR=European League Against Rheumatism. ACR=American College of Rheumatology. EMS=early morning stiffness.
Artrose er, er i motsetning til hva mange tror, en klinisk diagnose. Diagnosen stilles på bakgrunn av symptomer; smerte, kort morgenstivhet og funksjonelle begrensninger og en kort fysisk undersøkelse (krepitus, begrenset eller smertefull bevegelse, ømhet i ledd og hevelse). Passende bruk av diagnostiske kriterier (slik som fra American College of Rheumatology eller European League Against Rheumatism for kneartrose; se bilde) anbefales. I følge nyere retningslinjer for klinisk praksis kan en klinisk diagnose stilles hos en typisk artrosepasient uten behov for ytterligere undersøkelser når en person er >45 år og har aktivitetsrelaterte leddsmerter, morgenstivhet som varer <30min, crepitus ved aktivitet, smerter ved bevegelse, benforstørrelse og ingen palperbar varme. En skjønnsmessig vurdering av alvorlig(ere) årsaker til leddsmerter, herunder akutt artritt, fraktur, primær cancer eller metastaser er implisitt.
Ved atypiske presentasjoner kan bildediagnostikk være nyttig når den kliniske diagnosen er usikker. Imidlertid har det blitt understreket tidligere at mange strukturelle abnormiteter sett på bildediagnostikk er svært vanlige i eldre populasjoner og bør derfor vurderes i den aktuelle kliniske konteksten. Generelt antas det at det er mangel på samsvar mellom strukturelle radiografiske forandringer og symptomer på artrose. Minimale endringer kan være forbundet med mye smerte, og omvendt. En rekke traumer kan få et ledd til å reparere seg selv, ofte kompensere for det første traumet og resultere i et strukturelt endret, men symptomfritt ledd. Videre kan nøyaktigheten av assosiasjonen mellom symptomer og radiografisk artrose bli påvirket av operatør (radiograf, ortoped, radiolog osv.), definisjoner av smerte, kulturelle forskjeller og andre potensielle forvirrende elementer. Selv om mange studier har brukt bildediagnostikk til diagnostiske formål, er det mangel på studier der bildediagnostikk blir brukt i tillegg til kliniske funn for å evaluere om det foreligger noen ytterligere fordeler ved diagnosestillelse. På grunn av dette fraværet, anbefales således ikke systematisk bruk av bildediagnostikk i den diagnostiske prosessen i tilfeller med en typisk klinisk presentasjon av artrose. Avhengig av lokalisasjon og kliniske presentasjon kan imidlertid bildediagnostikk vurderes når det er mistanke om andre diagnoser enn artrose. Hvis bildediagnostikk er nødvendig, bør radiografi (konvensjonell røntgen) være førstevalget.
Håndtering av artrose
Generelt vil man kunne si at man har oppnådd konsensus omkring nøkkelprinsippene i håndteringen av artrose på internasjonalt plan [8,9].
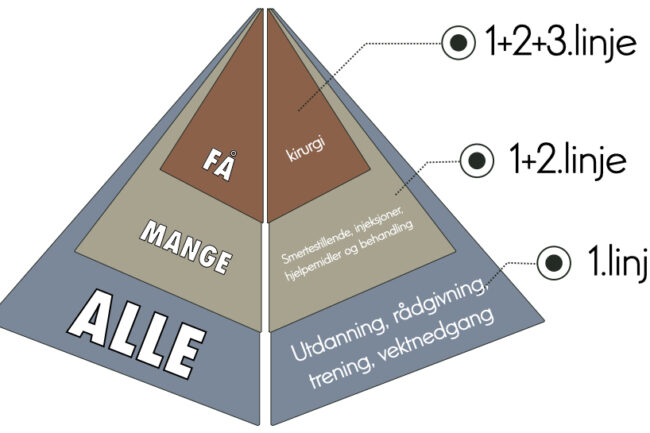
Førstelinjeterapi inkl. Treningsterapi
I retningslinjene er ikke-farmakologiske metoder bredt anbefalt og ansett som førstelinjeterapi. Dette inkluderer rådgivning, kunnskapsformidling, hjelp-til-selvhjelp, trening, vekttap ved overvekt eller fedme, ergonomiske råd og ganghjelpemidler. Spesielt viktig her er formidlingen av de siste femten årenes forståelse av artrose som en revmatisk leddsykdom som rammer hele individet, og ikke kun enkeltkomponenter i det smertefulle leddet. Det at pasienter forstår at man kan iverksette en lang rekke tiltak som totalt sett vil bedre leddhelsen synes derfor svært viktig. Her ligger det også avdramatiserende råd i forhold til funn på bildediagnostikk, og understreke at pasientens symptomer ikke er direkte forbundet med strukturelle avvik på bildediagnostiske modaliteter. Treningsterapi (bestående av styrketrening og generell aerob aktivitet) blir nå sett på som et av nøkkelelementene i håndtering av artrose, selv om man stadig ser utfordringer i implementeringen av dette tiltaket på populasjonsnivå, spesielt som et ledd i langsiktig håndtering. For vekttapsintervensjoner hos pasienter som er overvektige foreligger det mindre overbevisende dokumentasjon. Flere studier indikerer dog en dose-respons assosiasjon mellom mengden vekttap og effekten på smerte og funksjon, og studier indikerer også at effekten av vekttap og trening i kombinasjon har større effekt enn de to tiltakene isolert. Overvekt og fedme er, isolert sett og uavhengig av artrose, en stor folkehelseutfordring, og sammenhengen mellom overvekt og artrose understreker vanskelighetene med adekvat behandling av denne pasientgruppen. Har man først pådratt seg så sterke knesmerter at det vanskeliggjør trappegang og vanlig dagligdags aktivitet i tillegg til at man har betydelig overvekt, er det ikke vanskelig å anerkjenne utfordringen både pasienten og helsepersonellet rundt står ovenfor i håndteringen av denne tilstanden. The Lancet sine «Global Burden of Disease» studier indikerer også at man venter en betydelig vekst i andelen mennesker med morbid overvekt frem mot 2050, som etter alt å dømme vil gjøre at byrden av artrose stiger proporsjonalt. Dette understreker også viktigheten av at man under diskusjonen av håndteringen av artrose drøfter forebyggende elementer som leder til det retoriske spørsmålet: hvordan unngår vi at barn blir overvektige?». Dette har politiske og praktiske implikasjoner langt utenfor denne artikkelens formål.
Smertestillende medikamenter
Farmakologisk behandling som anbefales i retningslinjene er nesten alltid Paracetamol og NSAIDs. I 2017 konkluderte imidlertid en metaanalyse med at de svært små effektstørrelsene av paracetemol (mindre enn 0,2) sammenlignet med placebo, sammen med sikkerhetshensyn, gjør at det i liten grad kan anbefales som enkeltmiddel for behandling av artrose. Andre førstelinjemetoder som topikale NSAIDs har vist å være effektive for smertelindring ved artrose sammenlignet med placebo i en metaanalyse fra 2018 med gjennomsnittlige effektstørrelser på 0,30 for smertelindring og 0,35 for funksjon. For aktuelle NSAIDs er det så langt ikke observert alvorlige gastrointestinale eller renale bivirkninger i studier eller i den generelle befolkningen. Orale NSAIDs har vist seg å være effektive når det gjelder klinisk relevant forbedring av både smerte og funksjon, hvor effektstørrelsene i de tilgjengelige studiene varierer på tvers av ulike NSAIDs og doser. Men sikkerhet (spesielt knyttet til gastrointestinale og kardiovaskulære hendelser er en viktig vurdering ved valg av preparat og dose for individuelle pasienter, og bruken av orale NSAIDs er fortrinnsvis begrenset til kortvarig bruk (etter behov) ved lavest mulig dose.
Intraartikulære kortikosteroider anbefales for hofte- og kneartrose for pasienter som ikke har respondert på orale eller topikale analgetika. Imidlertid konkluderte den siste Cochrane-gjennomgangen i 2015 at evidens for klinisk effekt 6 er fortsatt uklart i lys av den generelle lave kvaliteten på forsøk.
En metaanalyse viste at tramadol eller tramadol i kombinasjon med paracetamol gir symptomlindring og forbedrer funksjon hos pasienter med artrose, men at disse fordelene er små. For ikke-tramadol opiater viste en metaanalyse fra 2014 at en risiko:nytteanalyse gjør at disse legemidlene ikke kan rutinemessig anbefales i behandlingen av artrose.
Kirurgi
Totalprotese i hofte og knær er klinisk relevant og kostnadseffektivt i riktig selekterte pasientgrupper. THA (total hip arthroplasty) har til og med blitt kalt «The operation of the century» [10]. Spørsmålet blir hvem som skal ha operasjonen og når?
Henvisning av pasienter med artrose til en kirurg bør vurderes dersom ikke-operativ behandling har blitt forsøkt, adekvat og konsekvent, over en periode på minimum 6 måneder, og pasienten rapporterer fortsatt sterke symptomer og funksjonsbegrensning. På hvilket tidspunkt man skal vurdere at ikke-operativ behandling ikke har vært tilstrekkelig må vurderes i hvert enkelt tilfelle, men typisk vil dette innebære betydelige leddsmerter som forstyrrer normal søvn og forårsaker en alvorlig reduksjon i forventet gangavstand (for alder) og markert begrensning av dagligdagse aktiviteter. Det er viktig at man er klar over at opptil 25% av pasientene som får totalprotese fortsatt rapporterer symptomer og funksjonsbegrensning 1 år etter fullført kirurgi [11]. Møysommelig selektering av pasienter synes svært viktig, og det må understrekes at man observerer dårligere resultater hos pasienter som er deprimerte, har minimal radiografisk sykdom, har minimale smerter og som er sykelig overvektige [12]. Delt beslutningstaking om kirurgi, hvor potensielle pasienter informeres grundig om forventet utfall, prognose, tidsaspekter, funksjonsforventninger og potensielle risikomomenter bør prioriteres for å minimere sannsynligheten for misfornøyde pasienter. Den randomiserte studien i 2015 som sammenlignet total kneprotese med ikke-kirurgisk behandling hos pasienter med kneartrose, viste at den totale kneprotesegruppen hadde større smertelindring og funksjonell bedring etter 12 måneder enn den ikke-kirurgiske gruppen [13]. Imidlertid var total kneprotese assosiert med mer alvorlige bivirkninger enn ikke-kirurgisk behandling, og de fleste pasientene i den ikke-kirurgiske gruppen gjennomgikk ikke total kneprotese før 12-måneders oppfølging. Komplikasjoner assosiert med totalprotese inkluderer kjente komplikasjoner som er felles med andre operasjoner (f.eks. venøs tromboembolisme og infeksjon på operasjonsstedet) samt komplikasjoner som er spesifikke for operasjoner som involverer ledd, slik som nevrovaskulær skade, infeksjon rundt protesen, fraktur i området rundt protesen og protesehavari.
Avslutning
Artrose er en revmatisk leddsykdom som kan ramme alle synoviale ledd, men hyppigst i kne, hofte og hånd. Prevalensen øker med alder og artrose regnes som èn av de hyppigste årsaken til uførhet på verdensbasis. En stor andel pasienter med artrose vil ha komorbiditeter i form av hjerte-/karsykdom, diabetes, økt kolsterol og overvekt. Forskningen de siste femten årene har vist at artrosens patogenese er langt mer enn bare redusert leddbrusk, og hele leddets strukturelle oppbygning affiseres ved en artrosetilstand. I tillegg påvirkes kroppen som system gjennom lavgradig inflammasjon. Diagnosen stilles klinisk, men kan suppleres ved bildediagnostikk ved behov for å utelukke differensialdiagnoser. Som med andre livsstilssykdommer så vil førstelinjeterapi i stor grad være rådgivning, kunnskapsformidling, ergonomiske tilpasninger, trening og vektnedgang (hvor indikert). Medikamentelle intervensjoner som Paracetamol, NSAIDs, glukokortikoider og opioder har en plass hos selekterte individer, men bruken bør være begrenset og selektert. En liten andel av pasienter må opereres, og det foreligger gode retningslinjer for hvilke pasienter som bør selekteres til kirurgi. Som kliniker er det viktig at man anerkjenner artrose som en kompleks leddsykdom som rammer hele individet. Behandling må foregå under prinsippene om delt beslutningstaking, og kunnskapsformidling om artrosens natur må ligge sentralt i pasientmøtet. Forhåpentligvis vil denne artikkelen gjøre at du står sterkere rustet i ditt neste møte med artrosepasienten.
REFERANSER:
- Hunter DJ, Bierma-Zeinstra S. Osteoarthritis. Lancet. 2019;393(10182):1745-59.
- Man GS, Mologhianu G. Osteoarthritis pathogenesis – a complex process that involves the entire joint. J Med Life. 2014;7(1):37-41.
- Loeser RF, et al. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum. 2012;64(6):1697-707.
- Torres L, et al. The relationship between specific tissue lesions and pain severity in persons with knee osteoarthritis. Osteoarthritis Cartilage. 2006;14(10):1033-40.
- Scanzello CR, et al. Synovial inflammation in patients undergoing arthroscopic meniscectomy: molecular characterization and relationship to symptoms. Arthritis Rheum. 2011;63(2):391-400.
- Turkiewicz A, et al. Current and future impact of osteoarthritis on health care: a population-based study with projections to year 2032. Osteoarthritis Cartilage. 2014;22(11):1826-32.
- Caughey GE, et al. Prevalence of comorbidity of chronic diseases in Australia. BMC Public Health. 2008;8:221.
- Block JA. Osteoarthritis: OA guidelines: improving care or merely codifying practice? Nat Rev Rheumatol. 2014;10(6):324-6.
- Nelson AE, et al. A systematic review of recommendations and guidelines for the management of osteoarthritis: The chronic osteoarthritis management initiative of the U.S. bone and joint initiative. Semin Arthritis Rheum. 2014;43(6):701-12.
- Learmonth ID, et al. The operation of the century: total hip replacement. Lancet. 2007;370(9597):1508-19.
- Wylde V, et al. Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. Pain. 2011;152(3):566-72.
- Dowsey MM, et al. Development of a Prognostic Nomogram for Predicting the Probability of Nonresponse to Total Knee Arthroplasty 1 Year After Surgery. J Arthroplasty. 2016;31(8):1654-60.
- Skou ST, et al. A Randomized, Controlled Trial of Total Knee Replacement. N Engl J Med. 2015;373(17):1597-606.